انتشار مقاله محققان دانشگاه تهران در مجله وابسته به دانشگاه کمبریج
به گزارش ایران اکونومیست، دکتر علیاکبر موسوی موحدی، رئیس مرکز تحقیقات بیوشیمی و بیوفیزیک دانشگاه تهران در این باره گفت: تغییر سبک زندگی در دنیای امروز، تنش و استرسهای مختلفی بر سلامت فردی و اجتماعی انسانها تحمیل کرده و موجب گسترش روزافزون شمار مبتلایان به بیماریهای صنعتی نظیر دیابت و سرطان شده است. مطالعات بسیاری بر نقش اساسی تولید و رهاسازی رادیکالهای آزاد در نتیجه این تنشها در بروز بیماریها مهر تائید زدهاند. هر چند که نظام آفرینش، سازوکارهای لازم برای مقابله با چنین تنشهایی را با ایجاد تعادل در بدن موجودات زنده تا آستانه مشخصی فراهم کرده است، با این وجود، افزایش چشمگیر تنشها در زندگی صنعتی امروز، تعادل ایجاد شده را به سود تجمع رادیکالهای آزاد در بدن سوق میدهد که میتواند تغییرات نامطلوبی را بر ساختار و عملکرد مولکولهای زیستی از جمله پروتئینها تحمیل کند.
وی با یادآوری اینکه ریشه مولکولی استرس و یا تنش، ناظر به موضوع تجمع رادیکالهای آزاد غیرمتعادل است که موجب تغییرات ساختاری و ناپایدار شدن پروتئینها، خارج شدن از حالت طبیعی، قرار گرفتن آنها در مسیرهای تجمعی و در نهایت بروز بیماریهایی نظیر آلزایمر، پارکینسون و دیابت میشود، افزود: در این بیماریها رسوب تجمعات پروتئینی موسوم به فیبریلهای آمیلوئیدی منجر به اختلال در عملکرد طبیعی اندامهای بدن میشود، به طور مثال تخریب سلولهای بتای پانکراس در اثر رسوب فیبریلهای آمیلوئیدی، ترشح انسولین را تحت تأثیر قرار داده و منجر به بروز دیابت نوع دو میشود.
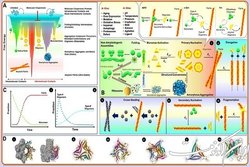
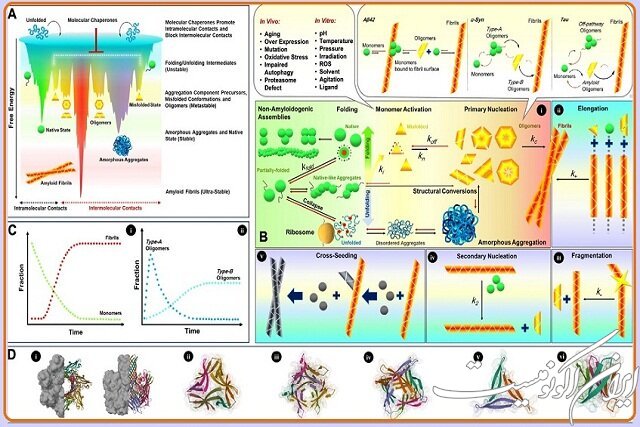
استاد ممتاز دانشگاه تهران خاطرنشان کرد: همچنین نقش رسوب فیبریلهای آمیلوئیدی در سلولهای عصبی، در ایجاد بیماریهای پیشرونده عصبی نظیر آلزایمر و پارکینسون نیز به اثبات رسیده است. اما موضوع از نقطه نظر مولکولی، بسیار پیچیدهتر است؛ زیرا مطالعات بسیاری سمیت فیبریلهای آمیلوئیدی را که محصول نهایی فرآیندهای تجمعی پروتئینها بهشمار میروند، در حدی نمیداند که به تنهایی مسئول ایجاد بیماریهای مذکور باشد. بنابراین اخیراً بحث الیگومرهای آمیلوئیدی که حدواسطها و پیشسازهای مسیرهای تجمعی پروتئینها محسوب میشوند و سمیت بسیار بیشتری از فیبریلها دارند، توجه فراوانی را به خود جلب کرده است.
به نقل از روابط عمومی دانشگاه تهران، دکتر موسوی موحدی افزود: از آنجایی که الیگومرهای سمی آمیلوئیدی به دلیل پایداری کم ترمودینامیکی و ساختارهای مولکولی ویژه کاملاً مجزا از الیگومرهای پروتئینی هستند که بار اصلی انجام عملیاتهای زیستی را به عهده دارند، نامزدهای اصلی ایجاد اختلال و نهایتاً تخریب سلولها و بروز بیماریهای صنعتی آمیلوئیدی فوقالذکر هستند. نظر به اهمیت بالای این موضوع، پژوهشگران مرکز تحقیقات بیوشیمی و بیوفیزیک دانشگاه تهران به دعوت نشریه Current Research in Structural Biology وابسته به دانشگاه کمبریج انگلستان، اقدام به انتشار مقاله مروری کردند که در آن ضمن بررسی مسیرهای تجمعی پروتئینها و سازوکارهای درگیر در آن، روشهای مدیریت این شرایط در موجودات زنده را نیز تشریح کردهاند.
وی افزود: بنابراین در این مقاله مروری که بر جنبههای ساختاری متمرکز است، از رمز و رازهای الیگومرهای پروتئینی پرده برداشته شده است و تاکید اصلی بر دو گروه از الیگومرهای پروتئینی موسوم به الگومرهای آمیلوئیدی و چاپرونهای مولکولی است که دسته اول تهدیدکننده سلول و دسته دوم (با مدیریت شرایط تنشی) ضامن سلامتی سلول محسوب میشوند. گفتنی است که سازوکارهای مولکولی درگیر در موارد فوق توسط نویسندگان مقاله، نقاشی مولکولی شده و در این مقاله به چاپ رسیده است.


